PHYSIQUE-CHIMIE - Devoir surveillé -506 – (5/3/09)
Questions de cours :
1)Qu'est-ce que la dispersion par un prisme ?
2)Quelle grandeur physique associe t-on à une radiation monochromatique ? Quelle est son unité ?
3)Quelles sont les différentes couleurs conventionnelles du spectre de la lumière blanche ?
4)Y a t-il un rapport entre la dispersion de la lumière blanche par un prisme et la réfraction ?
5)Qu'est-ce qu'un spectre d'absorption?
6)Quelle est l'unité de la constante d'Avogadro ?
7)Qu'est-ce qu'une masse molaire atomique ? Quelle est son unité ?
8)Que sont des isomères ?
Exercice
1 :
Les étoiles Rigel et Bételgeuse de la constellation d'Orion
sont des étoiles respectivement bleue et rouge.
De ces deux étoiles , quelle est celle dont la température de surface est la
plus élevée ? Justifier votre réponse.
Exercice 2 :
Un rayon lumineux monochromatique parvient à la surface air-eau en faisant un angle incident dans l'air égal à 20° . L'indice de l'eau est n=1,33 .
a)Réaliser un dessin du rayon incident en indiquant clairement l'angle d'incidence .
b)Calculer la valeur de l'angle réfracté .
3)Sur le dessin précédent , dessiner le rayon réfracté .
Exercice 3.
On a obtenu le spectre d'une étoile avec un spectrographe à
réseau. Les distances séparant deux raies sont proportionnelles à la différence
des longueurs d'onde correspondantes.
On fournit aussi le spectre d'émission de l'argon. Les longueurs d'onde
correspondant aux raies de cet élément sont indiquées en dessous.

1. Quel est l'intérêt de fournir le spectre de l'argon?
2. Le positionnement des raies du spectre de l'argon par rapport à la règle a permis de tracet la courbe l=f(d)

Déterminer (en utilisant la courbe) les longueurs d'onde des raies présentes dans le spectre de l'étoile.
Exercice 4 :
Données:Masses molaires atomiques : H : 1g.mol-1 ; Cl
: 35,5 g.mol-1
1)Quelles sont les structures électroniques du chlore (Z=17 , ligne 3 , colonne VII) et de l'hydrogène H (Z=1 , ligne 1 , colonne I))
2)Établir la représentation de Lewis de chacun de ces deux atomes.
3)Quelle est la représentation de Lewis de la molécule de chlorure d'hydrogène HCl.
4)Cette molécule contient combien de doublets liants , non liants ? Justifiez votre réponse .
5)Quelle est sa masse molaire ?
6)Combien y a t-il de moles de molécules dans 1 g de
chlorure d'hydrogène ?
Exercice 5 :
Equilibrer les réactions chimiques suivantes :
1-Al +
S ------> Al2S3
2- C2H6
+ O2 -------> CO2 + H2O
3- C2H6O
+ O2 --------> CO2
+ H2O
4-NO +
CO -------> N2 + CO2
correction
Questions de cours :
1/Si on envoie un faisceau de lumière (blanche par exemple) sur un prisme , celle-ci est décomposée selon les différentes couleurs qui la composent. Cette décomposition est due au caractère dispersif du prisme.
2/La grandeur physique associée à une radiation monochromatique est la longueur d'onde l . Celle-ci se mesure en unité de longueur , le mètre ou le nanomètre par exemple
3/Comme couleurs du spectre de la lumière blanche , nous pouvons citer : rouge,orange,jaune,vert,bleu, violet.
4/le caractère dispersif du prisme est du au fait que son indice de réfraction dépend de la longueur d'onde (couleur).C'est cette propriété qui est à l'origine de la décomposition de la lumière par le prisme . Il y a donc bien un rapport entre dispersion et réfraction.
5/On obtient un spectre d'absorption lorsqu'on éclaire en lumière blanche une vapeur d'atomes ou un liquide et qu'on décompose ensuite cette lumière avec un spectroscope (ensemble fente+prisme ou fente + réseau).Le spectre obtenu est constitué du spectre de la lumière blanche avec des raies ou des bandes noires (absorption de certaines couleurs par la vapeur d'atomes ou le liquide).
6/La constante d'Avogadro NA s'exprime en mol-1 .
7/ La masse molaire atomique est égale à la masse d'une mole d'atomes. Elle s'exprime généralement en g.mol-1 .
8/Deux molécules isomères ont la même formule brute , mais une formule développée différente . Elles ne sont donc pas superposables.
Exercice 1 :
Nous savons qu'un filament chauffé dans une ampoule permet de produire de la lumière. Or le spectre de cette lumière est d'autant plus riche en bleu que la température du filament est élevée . Des deux étoiles citées , Rigel (couleur bleue) est donc celle dont la température de surface est la plus élevée.
Exercice 2 :
1/

2/i est l'angle d'incidence , r l'angle de réfraction .En notant nair l'indice de réfraction de l'air et neau l'indice de réfraction de l'eau , la loi de Descartes pour la réfraction s'écrit ici : nair sin i = neau sin r ou sin r = sin i/1,33 sachant que nair=1 et neau=1,33.
D'ou sin r = 0,25
La calculette permet de déterminer l'angle r tel que son sinus est égal à 0,25 : r= 15° .
3/Le rayon réfracté est représenté sur le schéma ci-dessus.
Exercice 3 :
1/Le spectre de l'argon permet d'étalonner l'appareil de mesure . C'est à partir de ce spectre que l'on peut tracer la courbe l=f(d) .
2/Les raies d'absorption de l'étoile sont repérées avec l'appareil de mesure par leurs positions "d" en divisions. La courbe d'étalonnage l=f(d) permet d'en déduire la longueur d'onde correspondante.
|
d en div |
1 |
1,8 |
2,1 |
2,5 |
6,6 |
6,9 |
10,2 |
|
l en nm |
470 |
480 |
490 |
500 |
580 |
590 |
640 |
Exercice 4:
1/Structures électroniques : chlore Cl : (K)2(L)8(M)7 ; Hydrogène H : (K)1
Remarques : le chlore : ligne 3 donc trois couches , colonne VII donc 7 électrons sur sa dernière couche.
l'hydrogène : ligne 1 donc une couche , colonne I donc un électron sur sa dernière couche.
2/Modèles de Lewis:
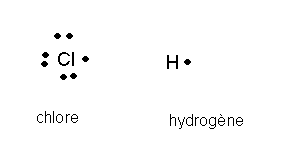
3/La molécule HCl

4/Cette molécule possède :
- un doublet liant qui assure la liaison de covalence entre l'atome de chlore et l'atome d'hydrogène.
-trois doublets non liants (n'assurent pas de liaison entre deux atomes)
5/Masse molaire moléculaire :
MHCl = MH + MCl = 1+35,5 = 36,5 g.mol-1 .
6/n=m/MHCl = 1/36,5 = 0,027 mol . C'est le nombre de moles de molécules de HCl dans 1 g de chlorure d'hydrogène.
Exercice 5 :
1- 2Al + 3S ---> Al2S3
2- C2H6 + 7/2 O2
----> 2CO2 + 3H2O
3- C2H6O + 3O2
----> 2CO2 + 3H2O
4- 2NO +
2CO ---> N2 + 2CO2